ⓔコラム10-15-4 胸腺腫・胸腺癌 (thymoma, thymic carcinoma)
定義・概念
胸腺腫と胸腺癌は胸腺の上皮細胞由来の腫瘍であり,おもに前縦隔に発生する.
疫学
胸腺腫は人口10万人に0.44~0.68人が発生するまれな疾患であり,胸腺癌はさらに頻度が少ない.40~60歳代の中高年層に多く,男女の差はない.
病理
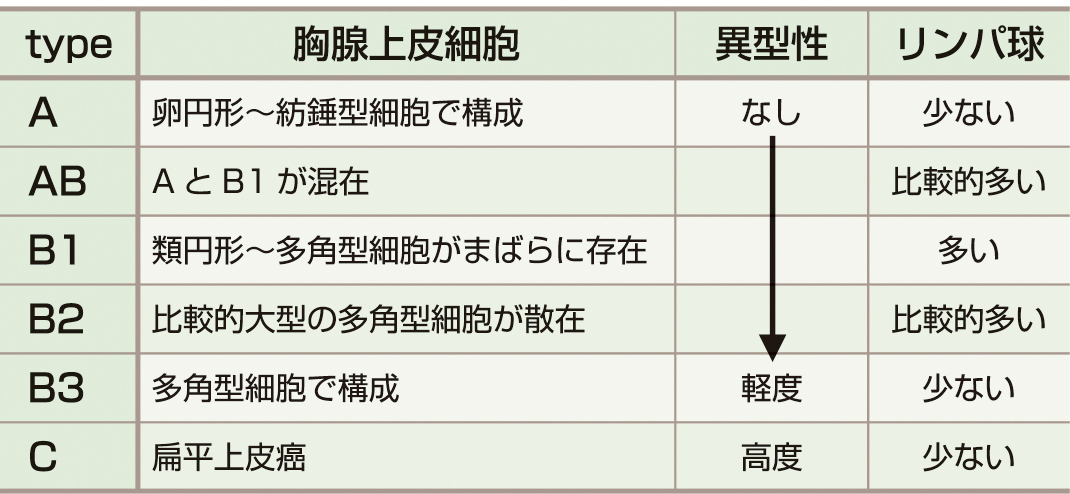
胸腺上皮由来の腫瘍細胞とリンパ球成分が混在するtwo cell patternの像を呈し,WHO分類では腫瘍細胞の形態と未熟Tリンパ球の多寡によって6つに分類される (表1)1).type AやABは予後が良好であるが,type B1,B2,B3の順にリンパ球成分が減少し,悪性度は高くなる.胸腺癌であるtype Cは,遠隔転移の頻度が高く予後不良である.
病期
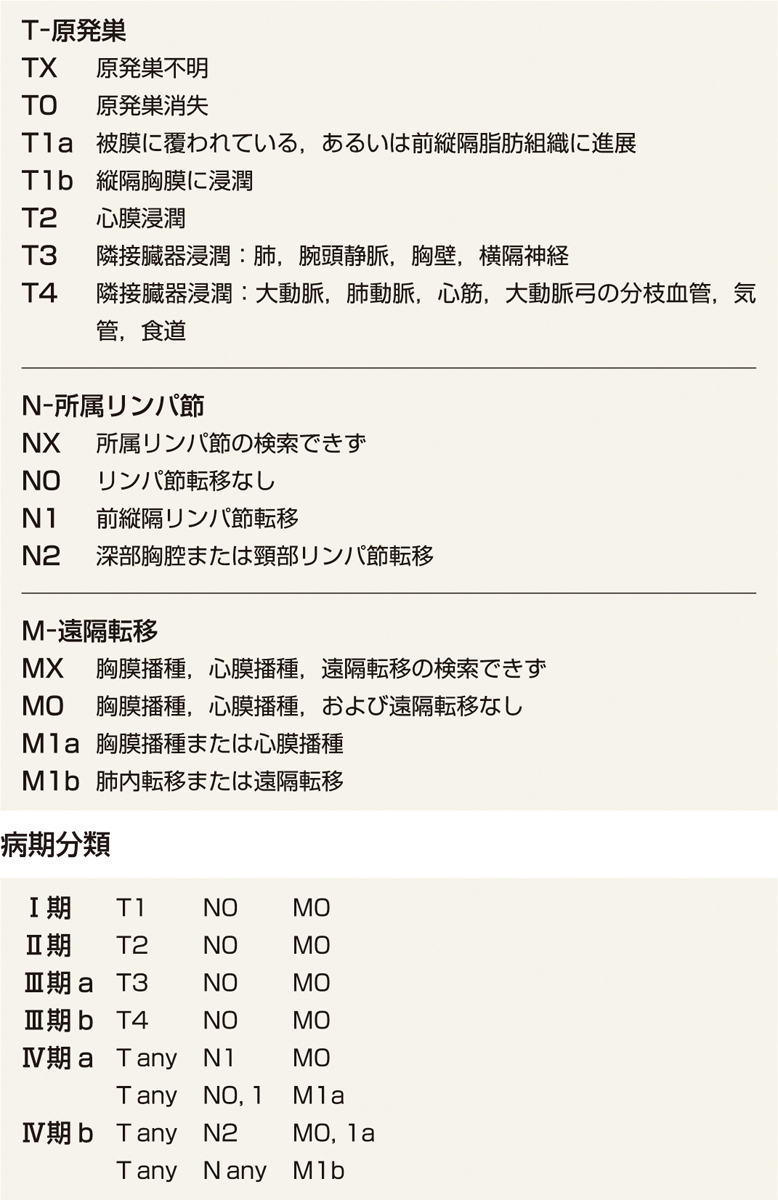
正岡分類 (表2)2)が広く用いられてきたが,現在はほかに正岡–古賀分類 (表3)3),UICCによるTNM分類 (表4)4)がある.


臨床症状
無症状で定期検診時に偶発的に発見されるほか,腫瘍による局所症状としては咳,胸部圧迫感,胸痛などがみられる.浸潤型胸腺腫の場合は上大静脈症候群や反回神経麻痺による嗄声などの症状や,胸水や心囊液貯留による呼吸困難などの症状を伴うことがある.
また,胸腺腫の場合は重症筋無力症などの傍腫瘍症候群による自覚症状を伴いやすく,比較的早期に診断される傾向がある.一方,胸腺癌は腫瘍の局所進展による症状がおもであり,進行期に発見されることが多い.
診断・検査
胸部X線写真,胸部CT,MRIにて前縦隔の腫瘤がみられる.非浸潤性胸腺腫は辺縁平滑な球状~長楕円型の腫瘤としてみられ,均一な造影効果を示す.浸潤性胸腺腫は分葉状で辺縁が不正であり,囊胞変性や石灰化を伴うことが多い5).
胸腺腫に合併した重症筋無力症のほとんどは抗アセチルコリン受容体抗体が陽性である6).また,無症状であっても術後重症筋無力症が発症することが報告されており,多くの場合は術前の抗アセチルコリン受容体抗体が陽性であった7).そのため,胸腺腫を疑う症例では測定することが推奨されている.頻度は少ないが,胸腺癌でも抗アセチルコリン受容体抗体の陽性例が報告されている.
画像診断の進歩により,縦隔腫瘍の鑑別もある程度は可能であるが,切除不能な症例や術前治療を計画する場合は,経皮的針生検や外科的生検による病理組織診断を行う.
合併症
重症筋無力症 (20~30%),赤芽球癆 (0.7~2.6%),低ガンマグロブリン血症 (0.4~0.7%) 等の傍腫瘍症候群を合併する8–10).
Good症候群は,成人発症の免疫不全症で,胸腺腫に低ガンマグロブリン血症を合併する症候群である11,12).末梢血B細胞の欠如・減少や,T細胞系にも異常がみられ,造血系の異常 (貧血,白血球減少症,血小板減少症など) を比較的高率で認めるほか,口腔扁平苔癬 (たいせん) や関節炎,全身性エリテマトーデスや潰瘍性大腸炎などの自己免疫疾患を合併することもある13).
予後
胸腺悪性腫瘍の5年生存率は胸腺腫が94.4%,胸腺癌が84.4%と胸腺癌の方が予後不良である8).
治療
胸腺腫における第一選択は外科切除である.隣接臓器に浸潤,胸膜播種が認められる症例であっても,完全切除を目指し,浸潤が高度な症例については術前の放射線治療や化学療法が考慮される.切除不能例や再発例に対しては,放射線治療やプラチナ製剤を主体とした化学療法が行われる.
傍腫瘍症候群を合併した場合は,胸腺腫の治療と合併症のコントロールが必要となる.縦隔脂肪組織内には異所性胸腺が存在することが報告されており,重症筋無力症を合併した症例や抗アセチルコリン受容体抗体が高値であった症例に対しては,前縦隔の脂肪組織を含めた広範囲胸腺・胸腺腫摘除術が行われる.
Good症候群では胸腺腫の摘出術によって改善しない場合も多く,免疫グロブリン補充療法が有効とされる14).赤芽球癆についても,胸腺摘出術で改善しない場合は免疫抑制療法を行う15).
〔谷村恵子・髙山浩一〕
■文献
Travis WD, Brambilla E, et al: WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart, International Agency for Research on Cancer, 2015.
Masaoka A, Monden Y, et al: Follow–up study of thymomas with special reference to their clinical stages. Cancer, 1981; 48: 2485–2492.
Koga K, Matsuno Y, et al: A review of 79 thymomas: modification of staging system and reappraisal of conventional division into invasive and non-invasive thymoma. Pathol Int, 1994; 44: 359–367.
Brierley JD, Gospodarowicz MK, et al: Union for International Cancer Control (UICC) TNM Classification of Malignant Tumors, 8th ed, Wiley–Blackwell, 2017.
Tomiyama N, Müller NL, et al: Invasive and noninvasive thymoma: distinctive CT features. J Comput Assist Tomogr, 2001; 25: 388–393.
Filosso PL, Guerrera F, et al: Outcome of surgically resected thymic carcinoma: a multicenter experience. Lung Cancer, 2014; 83: 205–210.
Nakajima J, Murakawa T, et al: Postthymectomy myasthenia gravis: relationship with thymoma and antiacetylcholine receptor antibody. Ann Thorac Surg, 2008; 86: 941–945.
Kondo K, Monden Y: Therapy for thymic epithelial tumors: a clinical study of 1, 320 patients from Japan. Ann Thorac Surg, 2003; 76: 878–884.
Nakajima J, Okumura M, et al: Japanese Association for Research of Thymus. Myasthenia gravis with thymic epithelial tumour: a retrospective analysis of a Japanese database. Eur J Cardiothorac Surg, 2016; 49: 1510–1515.
Padda SK, Yao X, et al: Paraneoplastic syndromes and thymic malignancies: an examination of the International Thymic Malignancy Interest Group retrospective database. J Thorac Oncol, 2018; 13: 436–446.
Good RA: Absence of plasma cells from bone marrow and lymph nodes following antigenic stimulation in patients with a gamma globulinemia. Rev Hematol, 1954; 9: 502–503.
Good RA: Agammaglobulinaemia–a provocative experiment of nature. Bull Univ Minn, 1954; 26: 1–19.
生越貴明,迎 寛:Good症候群.呼吸,2014; 33: 698–701.
Tarr PE, Sneller MC: Infections in patients with immunodeficiency with thymoma (Good syndrome). Report of 5 cases and review of the literature. Medicine, 2001; 80: 123–133.
Hirokawa M, Sawada K: Long–term response and outcome following immunosuppressive therapy in thymoma–associated pure red cell aplasia: a nationwide cohort study in Japan by the PRCA collaborative study group. Hematol, 2008; 93: 27–33.